Helicobacter pylori, фактори патогенності, ерадикаційної терапії.
Захворювання травного тракту займають одне з провідних місць в патології дитячого віку, їх поширеність серед дитячого населення в Україні досягла 148,95 - [6].
У структурі захворювань органів травлення провідне місце (50-75%) займає патологія шлунка і дванадцятипалої кишки [4, 6].
Заселяючи шлунок людини, Н.pylori може персистувати роки, десятиліття і навіть все життя. У багатьох пацієнтів Н.pylori може визначатися як симбіотичний і непатогенних мікроорганізм, що ускладнює вирішення питання про доцільність призначення специфічної терапії. Н.pylori є особливим патогенним агентом, який у більшості інфікованих викликає безсимптомний перебіг. Однак пацієнти з безсимптомним перебігом є групою ризику, в якій згодом розвивається хронічний гастрит, виразкова хвороба шлунка, виразкова хвороба дванадцятипалої кишки, екстранодальна В-клітинна MALT-лімфома або аденокарцинома шлунку [7, 18].
людина набуває H.pylori в ранньому дитинстві, зазвичай після першого року життя. Найбільш імовірна передача інфекції від матері до дитини та від дитини до дитини, ризик придбання інфекції високо корелює з інфекційним статусом матері та рідних братів / сестер, а також пов'язаний з умовами життя в перенаселених сім'ях [11, 12, 23].
Механізм передачі - контактно-побутовий. Однак Н.pylori швидко гине за межами шлунка людини внаслідок впливу більш високої концентрації кисню і навіть світла [15]. Найбільш ймовірні шляхи передачі - гастро-оральний (можливий при гастроентериті з блювотою), орально-оральний - при попаданні слини інфікованої людини до здорової (при поцілунках, тому що Н.pylori можуть виживати в слині і зубному нальоті, облизування сосок, користуванні спільними столовими приборами і ін.), рідко - ятрогенний (доведена можливість перенесення Н.pylori від однієї людини до іншої через погано оброблені інструменти при різних зондових процедурах, через недостатньо продезінфіковані ендоскопи та щипці для біопсій). Фекально-оральна передача можлива в умовах, при яких Н.pylori проходить транзитом через нижні відділи шлунково-кишкового тракту, що малоймовірно. Не виключається можливість передачі Н.pylori з мікроаерозолямі, які утворюються при розмові або кашлі [22].
Раннє дитинство - критичний період по інфікування Н.pylori. З віком ймовірність Н.pylori -інфікування зменшується. Н.pylori - єдиний відомий на сьогоднішній день мікроорганізм, який здатний до колонізації в умовах агресивного кислого середовища шлунка людини (але швидко гине при низькому значенні рН в просвіті шлунку). Н.pylori - особливий мікроорганізм, який інфікує людини протягом тисячоліть, має специфічну середовище проживання - адгезія Н.pylori відбувається тільки на епітелії шлунка і на ділянках шлункової метаплазії дванадцятипалої кишки або гетеротопии в товстій кишці [18, 11]. бактерія Н.pylori має розвинені складні захисні механізми, що дозволяють їй уникати агресивного впливу шлункового соку, виживати в слизовій оболонці шлунка, прикріплятися до шлункового епітелію і взаємодіяти як з ним, так і з імунними клітинами господаря [1, 7, 8, 12].
Н.pylori - мікроаерофільна грамотрицательная бактерія, що має вигнуту S-образну або злегка спиралевидную форму з полярно розташованими джгутиками. інша форма Н.pylori - коккоподібних. Пептидогликан стінки кокковидной форми бактерії є слабким активатором природного імунної відповіді. Перехід в коккоподібних форму може бути наслідком трансформації клітинної стінки з метою модуляції імунітету. Н.pylori перетворюється в коккоподібних форму в анаеробному просторі тонкого кишечника, фагоцитируется дендритними клітинами і стимулює імунітет господаря шляхом впливу на Пейєрових бляшки. H.pylori -позитивні особи мають популяцію імуноцитів, включаючи регуляторні Т-клітини, яка відсутня у H.pylori -негативних осіб. Ці клітини можуть проявляти системну імуномодулюючу активність. H.pylori має здатність формувати біоплівки, що сприяє стійкості бактерії до антибіотикотерапії і захищає від імунної відповіді хазяїна, тим самим збільшуючи її виживання в кислому і агресивному середовищі шлунку [20].
Н.pylori має виражені ензимні системи. Уреаза, головний фермент Н.pylori. розщеплює сечовину (в т.ч. харчових продуктів, сечовину з кров'яного русла) до аміаку і вуглекислоти. Уреазна активність виражена практично у всіх штамів Н.pylori, в зв'язку з чим використовуєтьсядля діагностики хелікобактеріоза. Наявність в своєму мікрооточенні -облачка- лужних продуктів охороняє збудника від впливу кислого середовища (буферний ефект аміаку) і сприяє розмноженню Н.pylori (РН 6,0-8,0). Відбувається своєрідний -обман- секреторного апарату - стимуляція гастрину, зниження секреції соматостатину і стала стимуляція соляної кислоти.
Наявність в шлунковому соку аміаку порушує митохондриальное і клітинне дихання, викликаючи некротичні пошкодження слизової оболонки шлунка і сприяючи розвитку антрального гастриту і гипергастринемии. Н.pylori виділяє муциназа, яка викликає деполимеризацию і розчинення захисного слизу шлунка, сприяючи підвищенню проникності для іонів водню. Н.pylori продукує також такі ушкоджують МОР ферменти, як каталаза (запобігає фагоцитоз Н.pylori ), Фосфоліпаза (руйнує сурфактаноподобний фосфоліпідний захисний шар МОР), гемолізин, ліпаза, протеаза, оксидаза, численні адгезини.
Найбільш вивченими факторами вірулентності НР є вакуолізується цитотоксин А (VacA), -островок патогенності- генів Сag-PAI, вбудований в геном найбільш вірулентних штамів НP, і його маркер цитотоксин-асоційований ген A (cytotoxic-associated gene - СagА) [8, 10 , 14, 18, 21].
Більше 40 генів патогенності (вірулентності) Н.pylori не розкидані по хромосомі, а зібрані в одному з її сегментів, названому -островком патогенності- - CаgPAI. -Островок Патогенності- вбудований в геном найбільш вірулентних штамів Н.pylori. Його маркер - білок CagA з мовляв. масою 120-140 кД, який кодується геном citotoxin associated gene А - СagA. Обов'язковий атрибут вірулентності - наявність в Cаg-PAI генів системи секреції IV типу (type IV secretion system - TFSS), які кодують макромолекулярні структури, що функціонують як дрібні голки для передачі бактеріальних агентів від Н.pylori в клітини господаря, вводять плазмидную ДНК, що дозволяє НР модулювати метаболізм епітеліоцитів слизової оболонки шлунка, включаючи і експресію протоонкогенов. Існує гіпотеза, що СagА PAI H.pylori може служити новій транспортною системою для секреції факторів вірулентності [8, 18, 21].
VacA - це цитотоксин, яка формує пори. VacA грає важливу роль в життєдіяльності Н.pylori в організмі людини. Щоб надати токсичну дію, VacA повинен бути секретуватися бактерією і доставлений в активній формі до мембрани клітини господаря, в якій він формує пори, що випускають назовні іони хлору [60]. У VacA є кілька токсигенних властивостей, які можуть впливати на результат інфекції і колонізації Н.pylori. Найбільш вивченим у VacA є ефект ендосомной мутації, що призводить до вакуолизации епітеліальних клітин. Передбачається, що VacA вбудовується в мембрани ендосомних бульбашок, формує пори з активними каналами іонів хлору і змінює склад аніонів всередині ендосом, що згодом призводить до осмотичного набухання. VacA здатний також викликати витік іонів дрібних молекул, таких як залізо, нікель, цукру і амінокислоти, порушуючи бар'єрну функцію щільних з'єднань без великих руйнувань їх цілісності. Можливо, це і є механізм, за допомогою якого Н.pylori отримує поживні речовини через неушкоджений епітеліальний бар'єр [14].
Іншою важливою особливістю патогенності Н.pylori є його здатність блокувати протонні помпи парієтальних клітин, в результаті чого минуща гипохлоргидрия сприяє інших інфекцій, наприклад гельмінтозів. При несприятливих умовах Н.pylori може трансформуватися в атипову кокової форму, тобто менш вразливу для антибіотиків, потім знову в повноцінну S-подібну форму.
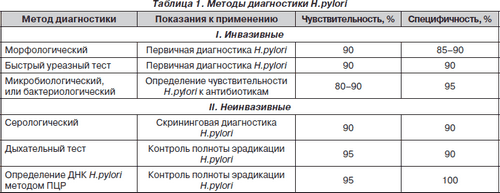
Серед усіх методів діагностики Н.pylori виділяють дві великі групи - інвазивні і неінвазивні методи. Інвазивні засновані на дослідженні біоптатів при проведенні ФЕГДС, неінвазивні не вимагають проведення ендоскопічного дослідження. До теперішнього часу не розроблено універсального методу діагностики Н.pylori. який би досяг 100% чутливості і специфічності. Кожен метод має свої переваги й недоліки, які визначають його показання до застосування в клінічній практиці [2, 4].
Методи діагностики представлені в табл. 1.
Відповідно до сучасних положень лікування НР-інфекції має бути економічно доступним для хворого, добре переноситися, забезпечуючи досить високу частоту ерадикації НР (не менше 80%).
Найбільш широко використовується семиденний трикомпонентна схема з інгібітором протонної помпи (ІПП) і двома антибіотиками. Дія цих препаратів спрямована як на зниження кислотоутворюючої функції шлунка, так і на знищення Н.pylori на поверхні слизової оболонки. ІПП не володіє антигелікобактерної активністю, але підвищує рН шлункового секрету. При цьому вегетативні форми Н.pylori. існуючі на поверхні слизової оболонки антрального відділу шлунка, захищають себе від впливу кислоти аміачної оболонкою, в лужних умовах гинуть під впливом утвореного ними ж аміаку. Відбувається своєрідне -самоубійство- Н.pylori. Ті бактерії, які збереглися в фундального відділі у вигляді коків, при збільшенні рН в шлунку переходять у вегетативну форму і стають доступними впливу антибіотиків.
Відповідно до положень Маастрихтського консенсусу-3, ерадикація Н.pylori у дітей проводиться тими ж препаратами, що і у дорослих, але з розрахунком добових доз ліків виходячи з маси тіла.
Якщо проведена схема лікування не привела до ерадикації Н.pylori. необхідно вважати, що бактерія стійка до препаратів, що входять в дану схему, і для ерадикації Н.pylori використовується чотирьохкомпонентної висмутсодержащие схема. При відсутності ефективності повторного курсу лікування необхідно визначити чутливість штаму Н.pylori до всього спектру використовуваних антибіотиків.
Контрольне дослідження необхідно провести через 6 тижнів після закінчення антихелікобактерної терапії і використовувати для цього два різних діагностичних методу. Біопсія повинна проводитися не тільки з антрального відділу, а й з тіла шлунка, куди можуть мігрувати бактерії на тлі лікування препаратами, що пригнічують шлункову секрецію.
Незважаючи на те що in vitroН.pylori високочутливий до медикаментозного впливу, лікування Н.pylori -асоційованого захворювання є тривалий процес, що вимагає певних зусиль як від лікаря, так і від пацієнта
Погоджувальна нарада -Маастріхт-3- настійно рекомендувало здійснення стратегії test and treat (тестування на Н.pylori і подальше лікування), яка вважається особливо показаною в країнах з високою інфікованістю населення H.pylori. Однак жодна з рекомендованих схем ерадикаційної терапії не досягає 100% ефекту. Чому ж все рекомендації так чи інакше звертають увагу лікаря на можливість невдалого результату ерадикаційної терапії?
Більш ніж 25-річний досвід лікування хелікобактерної інфекції показав, що ерадикація стає все більш важким завданням, оскільки мікроорганізм швидко набуває стійкість до антибактеріальних препаратів.
Незадовільні результати класичних ерадикаційної схем змушують проводити повторні курси лікування, в зв'язку з чим є потреба не тільки пошуку нових ефективних схем ерадикації першої лінії, оптимально працюють в умовах високої антибіотикорезистентності, а й розробки нових напрямків у проведенні антигелікобактерної терапії, впливаючи на інші ланки патогенезу хелікобактерної інфекції.
Розкриття молекулярних механізмів неспе-цифические вродженого імунітету, зокрема ролі Toll-like рецепторів (TLR) і TLR-аксесуарних молекул, дозволило уточнити значення останніх у розвитку хелікобактерної інфекції у дітей. Особливу роль у розвитку інфекційно-запального процесу, викликаного грамнегативними інфекційними агентами, в тому числі H.pylori. відіграє TLR4. TLR4 бере участь в розпізнаванні широкого діапазону лігандів, зокрема LPS грамнегативних бактерій, у тому числі і LPS H.pylori. Рекогніція PAMP інфекційних агентів TLR відбувається при безпосередньому їх взаємодії або при взаємодії, опосередкованому аксесуарна молекулами [1, 3, 12, 19, 23].
З огляду на важливу роль TLRs в реалізації вродженого імунної відповіді TLR-аксесуарних молекул, що беруть участь в рекогніціі LPS H.pylori. зокрема sCD14, новим напрямком при лікуванні хелікобактерної інфекції в дітей можливо медикаментозна регуляція активності TLR4 та продукції sCD14.
Розвиток та перебіг пептічної віразкі шлунка та дванадцятіпалої кишки супроводжуються.